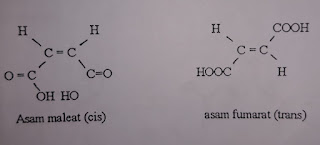I.
Judul Praktikum
“Keisomeran Gravimetri”
II. Hari,
Tanggal Praktikum
Jumat, 26 April 2019
III. Tujuan
Praktikum
Adapun tujuan dari dilakukannya
praktikum ini adalah :
1. Dapat
mengetahui azas dasar keisomeran ruang, khususnya isomer geometri.
2. Dapat
mengetahui perbedaan konfigurasi cis dan trans secara kimia dan fisika.
IV. Landasan
Teori
Sifat-sifat
molekul sangat sering ditentukan oleh struktur ruang atom-atom dalam molekulnya
karena biasanya jika ada dua gugus fungsii yang reaktif yaitu cis dan trans
yang sangat berkaitan satu dengan lainnya akan lebih mudah ditunjukkan secara
kimia perbedaan geometrinya seperti contohnya asam maleat dan asam fumarat yang
merupakan cis asam butenadioat. Anhidrit maleat dan 1 molekul air dapat didapat
dengan cara memanaskan asam maleat dalam suatu tabung tertutup yang berada
diatas titik lelehnya yaitu 1300C.
Asam
fumarat tidak akan meleleh tetapi justru akan menyublim pada suhu 1280C
dan akan membentuk anhidrida polimerik atau pada keadaan suhu yang tinggi akan
berubah menjadi anhidrida maleat (Tim Kimia Organik, 2016).
Adanya
proses isomerisasi membuat terjadinya perubahan struktur geometris senyawa
karotenoid yaitu dari konfigurasi trans menjadi cis. Hal ini berbeda dengan
proses oksidasi, dimana oksidasi membuat perubahan senyawa α- dan β- karoten
ditandai dengan terbentuknya epoksi-epoksinya hingga terbentuknya senyawa karotenoid
baru dengan berat molekulnya yang lebih rendah. Pengelolaan CPO dapat dilakukan
dengan serangkaian proses yang selalu melibatkan pemanasan dan pada proses
sterilisasi pemanasan dilakukan hingga mencapai suhu 142,90C
sedangkan pada proses pembantingan buah, pelumatan, ekstraksi minyak,
karifikasi dan purifikasi suhu dipertahankan pada 880C-900C
(Reni, 2008).
Isomer
merupakan molekul-molekul yang memiliki kesamaan pada rumus kimianya atau
sering juga dengan jenis ikatannya yang sama tetapi mempunyai susunan
atom-atomnya yang berbeda. Pada umumnya, isomer memiliki sifat kimia yang mirip
antara satu dengan yang lainnya dan juga terdapat sebuah istilah ismer nuklir.
Isomer nuklir adalah inti-inti atom yang mempunyai tingkat eksitasi yang
berbeda. Contoh yang paling sederhananya yaitu isomer dengan rumus kimia C3H8O.
Dari contoh tersebut, terdapat tiga isomer dengan rumus kimia yang mirip yaitu
2 molekul alkohol dan 1 molekul eter (Vogel, 2007).
Pada
umumnya, keisomeran cis an trans terjadi pada beberapa senyawa kompleks yang
memiliki bilangan koordinasi yaitu 4,5 dan 6 tetapi untuk bilangan koordinasi
4, keisomeran hanya akan terjadi pada bagian yang berisi 4 ligan-ligan yang
jaraknya sama ke logam pusat. Contohnya, senyawa kompleks platina(II), [Pb(NH3)2-Cl2]
memiliki dua senyawa isomer yang berbeda kelarutannya dan juga warnanya serta
sifat-sifatnya (Keenan, 2005).
Sebuah
senyawa organik bisa memiliki kemampuan yang gugus fungsinya dapat terikat pada
atom karbon dan membentuk ikatan tunggal maupun rangkap. Gugus fungsi ataupun
atom yang berikatan dengan atom karbon lainnya dan membentuk ikatan tuggal akan
bebas berotasi sepanjang ikatan tunggal –C-C- sehingga akan sulit atau bahkan
tidak dapat dibedakan orientasi bidang ruang gugus fungsinya ataupun sebaliknya
suatu gugus atau atom yang berikatan dengan senyawa organic lain yang memiliki
ikatan rangkap atau rantai karbonnya berbentuk siklik akan tidak bisa berotasi
bebas sehinnga orientasi gugusnya bisa kita identifikasi. Orientasi ruang gugus
atom inilah yang dinamakan dengan isomer geometri.
Pada
senyawa organic rantai siklik kita dapat menemukan isomer geometri, sprit pada
cincin karbon sikloalkana terbentuk bidang
pseudo yang biasanya digunakan untuk menetapkan orientasi relative atom
maupun gugus yang sebelumnya telah terikat oleh cincinnya tersebut
(stereokimianya). Pada suatu cincin, orientasi atom atau gugus yang berada pada
sisi cincin biasanya disebut “atas” dan jika berada pada sisi cincin lainnya
biasa disebut “bawah” (
V. Alat
dan Bahan
5.1 Alat
-
Erlenmeyer 125 mL
-
Corong buncher
-
Labu 100 mL
-
Alat refluks
-
Melting blok logam
5.2 Bahan
-
Anhidrida meleat
-
Aquadest
-
HCl 15 mL
VI. Prosedur
Kerja
a. Dididihkan
20 mL air suling dalam Erlenmeyer 125 mL
b. Ditambahkan
15 gr anhidrida meleat, anhidrida ini mula-mula akan melebur (1530C),
kemudian bereaksi dengan air menghasilkan asam meleat yang sangat larut dalam
air panas (400 gr/100 mL air panas) bahkan mudah larut dalam air dingin (79
gr/100 mL) pada 250C
c. Didinginkan
labu dibawah pancaran air kran sampai sejumlah maksimum asam meleat mengkristal
dari larutan
d. Dikumpulkan
asam meleat diatas corong buncher, dikeringkan dan ditentukan titik lelehnya
(jangan dibuang filtrat yang mengandung banyak meleat tersebut)
e. Dipindahkan
larutan filtrat ke dalam labu buncher 100 mL
f. Ditambahkan
15 mL HCl pekat dan direfluks perlahann-lahan selama 10 menit. Kristal asam
fumarat akan segera mengendap dari larutan (kelarutannya dalam air 9,8 gr/100
ml dan 0,7 gr/100 ml pada 250C)
g. Didinginkan
larutan pada suhu kamar, dikumpulkan asam fumarat dalam corong buncher dan
rekristalisasi dalam air (kira-kira 12 ml/gr asam)
h. Ditentukan
titik lelehnya dengan menggunakan melting blok logam.
i.
Dicatat hasilnya.
Link Video : https://www.youtube.com/watch?v=Jz33rBxxsqU&t=1s
Pertanyaan :
1.
Apa fungsi dari diberikannya air hangat
ke dalam labu alas bulat?
2.
Apa fungsi ditambahkannya HCl pekat ke
dalam labu yang berisi asam maleat?
3.
Berapa lama waktu yang baik untuk
melakukan proses refluks?